3월 24일, ‘세계 결핵의 날’을 맞이하여 국경없는의사회는 주요 국제 의료 단체들과 함께 오는 4월 1일 ‘endTB’ 프로젝트를 시작한다고 발표했습니다. 이 프로젝트는 다제내성 결핵 환자들에게 새로운 희망이 되고 있는 신종 결핵 치료제를 더 많은 다제내성 결핵 환자들에게 제공하는 것을 주요 목표로 하고 있습니다.
세계 결핵의 날인 3월 24일을 기념하여 국경없는의사회(MSF)는 파트너스 인 헬스(PIH), IRD(Interactive Research and Development), 국제의약품구매기구(UNITAID)와 함께 오는 4월 1일 ‘endTB’ 프로젝트를 시작한다고 발표했다. ‘endTB’는 다제내성 결핵 치료법의 근본적인 개선을 목표로 두고 이들 단체가 파트너십을 맺어 진행하는 합작 프로젝트다.
이들은 ‘endTB’ 프로젝트를 통해 2019년까지 4년간 세계 16개국 다제내성 결핵 환자 2600명에게 신종 결핵 치료제 베다퀼린(제품명 서튜러)과 델라마니드(제품명 델티바)를 공급한다. 이 2가지 신약은 50여 년 만에 처음으로 나온 새로운 결핵 치료제로, 다제내성 결핵 환자들에게 새로운 희망이 되고 있다. ‘endTB’는 세계보건기구(WHO) 권고에 따라 이 결핵 치료제들을 사용하며 이를 복용하는 환자 그룹을 모니터링할 계획이다.
또한 추가로 다제내성 결핵 환자 600여 명을 대상으로 완전히 새로운 다제내성 결핵 치료법의 임상시험을 실시할 계획이다. 기존 치료법보다 치료 기간이 짧고 환자 친화적인 이번 임상시험 대상 치료법들에서 안전성과 효능이 입증된다면 매우 획기적인 성과가 기대된다.
베다퀼린과 델라마니드가 다제내성 결핵 치료제로 승인된 지 벌써 1년이 넘었지만 그 동안 이 두 가지 신약은 거의 사용되지 못했다. 다제내성 결핵 환자가 많은 나라에서 이들 신약을 구하는 방법은 ‘동정적 사용(치료약이 없을 때 실험 약물을 사용할 수 있게 하는 방법)’으로만 가능하기 때문인데, 그러려면 다른 치료제가 없는 환자가 이 약을 구할 때마다 매번 제조업체로부터 약품 사용 허가를 받아야 한다.
지금까지 베다퀼린을 복용한 환자는 채 1000명이 되지 않는 것으로 추산된다. 델라마니드는 ‘동정적 사용’을 통해 공급되기는 하지만, 아직도 많은 환자들이 약을 구하기가 어렵다. endTB 프로젝트는 다제내성 결핵으로 고통 받는 수십만 명의 환자들에게 이 약들을 제공할 수 있는 기반을 마련할 것이다.
이 신약들은 환자와 가족들에게 새 희망을 안겨주고 있습니다. 하지만 치료제 자체는 절반의 승리밖에 되지 않습니다.
국경없는의사회 프란시스 바레인(Francis Varaine) 박사
국경없는의사회에서 ‘endTB’ 프로젝트를 주도하는 프란시스 바레인(Francis Varaine) 박사는 “다른 약들과 함께 복용했을 때 안전하고 효과가 있는지 더 면밀하게 확인해야 합니다. 또한 이상적인 치료 기간과 부작용도 조사해야 합니다. 이 모든 단계를 완료한 뒤에야 신약이 다제내성 결핵과의 싸움에서 실제로 판도를 바꿀 수 있습니다.”라고 말했다.
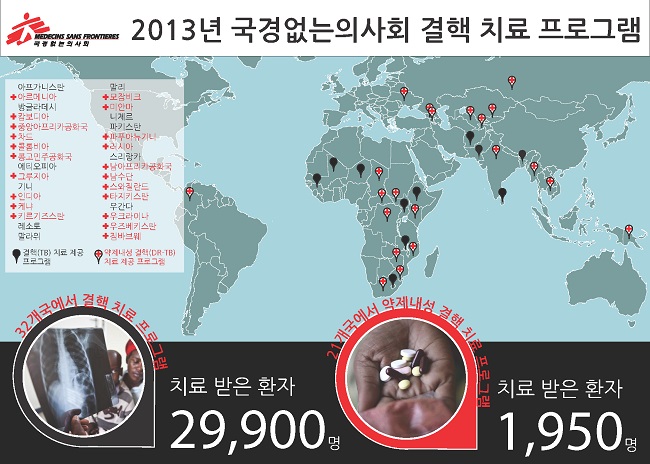
앞으로 4년간 진행되는 endTB 프로젝트는 오는 4월 1일 공식 런칭한다. 국제의약품구매기구(UNITAID)의 지원금으로 마련하는 프로젝트 재원은 총 미화 6040만 달러(한화 약 678억 원)에 달한다. 결핵 신약(베다퀼린, 델라마니드)을 받을 다제내성 결핵 환자 2600명 등록은 총 16개국에서 이뤄진다. (대상 16개국: 아르메니아, 방글라데시, 벨라루스, 북한, 에티오피아, 조지아, 카자흐스탄, 케냐, 키르기스스탄, 인도, 인도네시아, 레소토, 미얀마, 네팔, 파키스탄, 페루) 치료제에 대한 반응 및 부작용을 확인하기 위해 각 환자들의 상태를 면밀히 관찰할 예정이다.
또한, 총 5곳(현재 선별 중)에서 각각 결핵 신약 1종을 포함시킨 새로운 다제내성 결핵 치료법 몇 가지의 안전과 효능을 연구하는 임상시험을 실시한다. 이를 위한 환자 등록은 2015년 후반에 착수 예정이다. 베다퀼린과 델라마니드 2종 모두를 조합하는 치료법은 다른 연구들에서 뒷받침될 경우 다음 단계 임상시험에 포함될 수 있다.
또한 이번 프로젝트는 결핵 신약을 사용하는데 있어서 기존의 국가 장벽을 낮출 것이다. 이로써 여러 나라에서 결핵 치료제 등록을 장려하고, 이들 신약의 조달 체계를 빠르고 간편하게 촉진하는 방법을 제시할 것이다. 나아가 이 프로젝트는 WHO가 권고한 결핵 신약 사용을 지지하는 기반을 더욱 넓힐 것이다.
베다퀼린과 델라마니드는 근 50년 만에 처음으로 나온 새로운 결핵 치료제다. 베다퀼린(제품명 서튜러 정)은 얀센제약에서, 델라마니드(제품명 델티바 정)는 오츠카제약에서 만든다. 2012년 말, 미국 식품의약국(FDA)은 베다퀼린을 다제내성 결핵 성인 환자 치료제로 조건부 승인했다. 2013년 11월에는 유럽의약국(EMA)이 델라마니드의 판매를 조건부 승인할 것을 권고했다. 두 약품 모두 임상시험 2단계에서 결핵에 효과를 나타냈으며, 현재 델라마니드에 대한 임상시험 3단계가 진행 중이다.
국경없는의사회 보고서 보기>
*약제내성 결핵 치료제에 대한 접근성 강화에 걸림돌이 되는 여러 가지 제약, 그리고 이를 해결하기 위해 필요한 일들을 간략히 제시하는 보고서